

2022年11月23日,國際化學領域頂級期刊Journal of the American Chemical Society(JACS, IF=16.383)在線發表了我校BETVLCTOR伟德唯一官网董廖斌教授團隊的最新研究成果"Discovery, structure, and mechanism of a class II sesquiterpene cyclase"。2022級博士研究生潘興明和2020級碩士研究生杜雯煜為本文的共同第一作者,董廖斌教授、南京大學張博副教授、美國佛羅裡達大學Jeffrey D. Rudolf助理教授為本文的通訊作者,中國藥科大學為本文第一通訊單位。
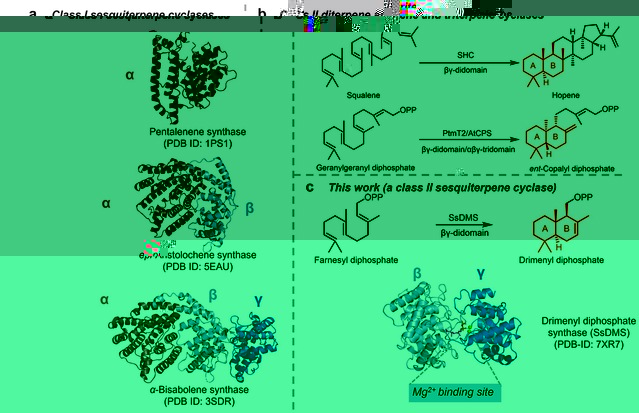
萜類天然産物作為自然界數量最多,結構最多樣化的天然産物家族,廣泛存在于各種生命形式中,發揮着舉足輕重的作用。絕大部分萜類天然産物來自于共同的線性焦磷酸前體,而萜類環化酶負責環化該線性前體生成多環結構的萜類天然産物。根據萜類環化酶不同的催化機制及蛋白結構,分為I型與II型萜類環化酶。I型萜類環化酶的晶體結構及對應的鎂離子結合位點經過數十年的研究已得了詳細的解析;而對應的II型萜類環化酶,由于僅獲得7個蛋白結構,其對應的鎂離子結合位點尚未闡明,嚴重阻礙了後續深入的機制研究。
該研究首先通過基因組挖掘技術靶定到兩株放線菌中的SsDMS及ScDMS蛋白,二者均能在體内産生drimenol倍半萜天然産物,并經過體外酶學實驗證實其為II型萜類環化酶。進一步利用蛋白質結晶技術,得到高分辨率的SsDMS (PDB-ID: 7XQ4, 1.58 Å),其具有經典II型萜類環化酶的βγ雙結構域。本工作還獲得了4個不同的蛋白質-底物複合物結構 (PDB-IDs: 7XQZ, 7XRA, 7XRU, 7XR7)。通過分析複合物的電子雲密度圖,首次發現了II型萜類環化酶的金屬鎂離子結合位點——位于線性法尼基焦磷酸底物的焦磷酸基團以及E169谷氨酸殘基之間。對比apo-SsDMS及其複合物晶體結構,發現R132, W165/L166, E169均發生了一定的位移,分别承擔了“焦磷酸感應器”,“守門人”及“鎂離子結合氨基酸”的角色。最後,通過定點突變多個關鍵殘基位點,詳細闡明了這一特殊的II型倍半萜環化酶的催化機制。
上述工作得到了國家自然科學基金面上項目(NSFC82073746),國家青年人才項目,“江蘇特聘教授”以及“雙一流”大學項目等資助。
文章鍊接:https://doi.org/10.1021/jacs.2c09412
撰稿人: 王增援
CopyRight BETVLCTOR伟德唯一官网 - 伟德官网下载客户端 版權所有
地址:江蘇省南京市江甯區BETVLCTOR伟德唯一官网