

BETVLCTOR伟德唯一官网譚甯華教授團隊在《藥學學報》英文刊(Acta Pharmaceutica Sinica B,2022;12(4):2103e2119)發表了一篇關于乏氧腫瘤聯合治療的研究論文:聯合天然環肽介導的化學療法與檢查點阻斷免疫療法的仿生納米遞藥系統用于克服腫瘤乏氧。
癌症免疫療法(Cancer immunotherapy)如癌症疫苗治療、細胞因子治療、嵌合抗原受體(CAR)-T細胞治療等療法在臨床患者中具有較高的總應答率,已經成為癌症研究最熱門的領域之一。在衆多的免疫療法中,基于免疫檢查點阻斷的免疫治療展現出了令人滿意的臨床治療效果。其中,PD-1/PD-L1通路作為該療法的重要靶标受到越來越多的關注。腫瘤細胞表面的PD-L1和T細胞的PD-1結合後,通過抑制細胞因子的分泌,誘導T細胞凋亡而産生腫瘤免疫逃脫現象。因此,阻斷PD-1/PD-L1的結合可以在一定程度改善耗竭的T細胞,從而促進腫瘤免疫應答。然而,單一的免疫檢查點阻斷治療在部分患者身上僅顯示較低的治療效果,這可能是由于複雜的免疫抑制微環境所緻。
化學療法可以通過多種機制增強抗腫瘤免疫反應,如刺激免疫原性細胞死亡來刺激免疫系統,抑制腫瘤免疫微環境中的免疫抑制途徑等。但部分化療藥物會導緻腫瘤細胞PD-L1的表達,從而影響其聯合免疫治療的效果。譚甯華教授團隊長期從事天然環肽的研究(Chem Rev 2006;106:840-95),其中,環肽RA-V因其較好的抗腫瘤活性受到更多的關注。前期她們的研究顯示,環肽RA-V可抑制缺氧誘導因子HIF-1α的表達(Biomater Sci 2020;8:256-65)。由于很多研究證明腫瘤乏氧往往會導緻腫瘤免疫逃脫現象,例如HIF-1α的表達會促進腫瘤PD-L1的表達,因此環肽RA-V改善腫瘤乏氧微環境的同時對腫瘤PD-L1的表達也可能産生抑制作用,這為該文提出聯合其與免疫檢查點免疫治療的策略提供理論基礎。
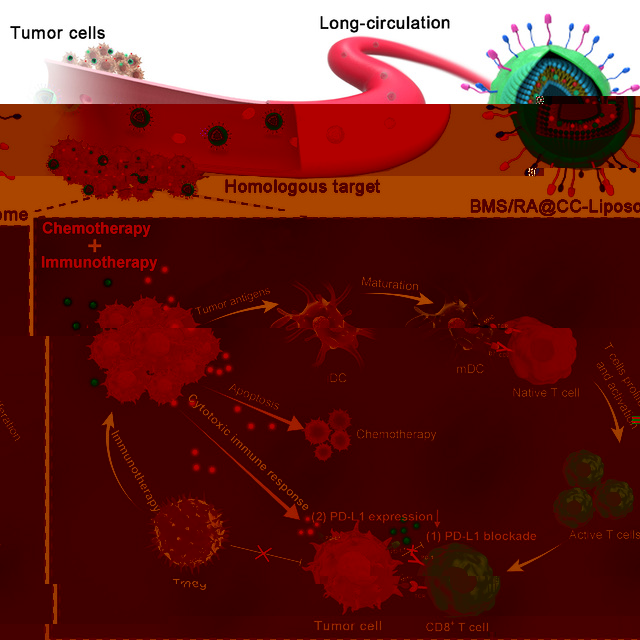
到目前為止,基于細胞膜的納米藥物遞藥系統在腫瘤靶向遞送方面已經取得了較為顯著的進展,如血小闆膜納米顆粒、中性粒細胞膜納米顆粒、紅細胞膜納米酶和癌細胞膜納米顆粒。在該文研究中,該團隊設計并制備了結腸癌細胞膜包覆的pH敏感型脂質體仿生納米顆粒(BMS/RA@CC-Liposome),用于天然環肽RA-V和免疫檢查點抑制劑BMS的聯合包載,使其高效,精準地遞送于乏氧腫瘤。實驗結果表明,BMS/RA@CC-Liposome顯示了抗吞噬作用和同源靶向性,實現了體内長循環效應和腫瘤靶向效果。此外,BMS/RA@CC-Liposome有效抑制了小鼠腫瘤的生長,這歸結于化學療法-免疫療法的協同聯合效果。在化學療法層面上,BMS/RA@CC-Liposome包載的RA-V直接殺傷腫瘤細胞,抑制其增殖。在免疫療法層面上,BMS/RA@CC-Liposome對PD-1/PD-L1的雙重作用促進了抗腫瘤免疫反應:一方面,RA-V直接抑制了腫瘤細胞PD-L1的表達,中斷腫瘤細胞PD-L1與PD-1的結合;另一方面,免疫檢查點抑制劑阻斷了PD-1/PD-L1的結合,以防止未被PA-V抑制的腫瘤細胞PD-L1與PD-1結合,這兩種藥物實現了對PD-1/PD-L1的雙重幹預,從而引起更強烈的抗腫瘤免疫反應。BMS/RA@CC-Liposome提供了基于PD-1/PD-L1通路免疫療法的優化組合治療的新策略,為乏氧腫瘤免疫治療帶來新思路。
供稿人:姚永榮
CopyRight BETVLCTOR伟德唯一官网 - 伟德官网下载客户端 版權所有
地址:江蘇省南京市江甯區BETVLCTOR伟德唯一官网